Halo Sobat Ternak, pada kesempatan ini, Sinaurternak akan membagikan sebuah makalah biokimia ternak yang berjudul Enzim Lipase dari Mikroba.
Simak terus makalah ini ya.
BAB 1. Pendahuluan
A. Latar Belakang
Enzim adalah golongan protein yang disintesis oleh sel hidup dan mempunyai fungsi penting sebagai katalisator dalam setiap reaksi metabolisme yang terjadi pada organisasi hidup. Enzim juga merupakan biokatalisator yang menunjang berbagai proses industri. Hal ini disebabkan enzim mempunyai efisiensi dan efektifitas yang tinggi, reaksinya tidak menimbulkan produk samping, serta dapat digunakan berulangkali dengan teknik amobilisasi (Lehninger, 1995).
Untuk memproduksi enzim dalam jumlah besar dan mempunyai aktivitas yang tinggi, perlu diperhatikan faktor-faktor penting seperti kondisi pertumbuhan, cara isolasi, serta jenis substrat yang digunakan. Kondisi pertumbuhan yang menunjang produksi enzim secara maksimal adalah pH, suhu inkubasi, waktu inkubasi, dan komposisi media pertumbuhan harus mengandung sumber energi, sumber karbon, sumber nitrogen dan mineral (Wang, 1979).
Pengunaan enzim dalam bioteknologi modern semakin berkembang secara cepat. Banyak industri-industri yang telah memanfaatkan kerja enzim, meliputi industri pangan dan non pangan.
Salah satu jenis enzim yang mempunyai peran penting dan tidak ada bandingan dalam pertumbuhan bioteknologi adalah enzim lipase. Enzim ini memiliki sifat khusus dapat memecahkan ikatan ester pada lemak dan gliserol. Selain itu, lipase mempunyai kemampuan mengkatalis reaksi organik baik didalam media berair maupun dalam media non air (Sumarsih, 2004). Enzim lipase sangat berperan dalam pemisahan asam lemak dan pelarutan noda minyak pada alat industri agar minyak dapat dilarutkan dalam air. Beberapa reaksi yang dikatalisis oleh enzim lipase diantaranya adalah reaksi hidrolisis, alkoholisis, esterifikasi,dan interesterifikasi (Dosanjh dan Kaur, 2002).
Disamping dari tanaman dan hewan, dewasa ini lipase mulai diproduksi dari berbagai mikroorganisme. Keuntungan memproduksi enzim dari mikroorganisme menurut Suhartono (1989) adalah produksi enzim dapat ditingkatkan dalam skala besar dalam ruangan yang relatif terbatas. Bakteri merupakan salah satu mikroorganisme yang dapat menghasilkan enzim lipase, karena bakteri memiliki kemampuan hidup di berbagai lingkungan yang terdapat kandungan makanan atau nutrisi yang kompleks. Oleh sebab itu pada makalah ini kami akan mengkaji enzim lipase dari mikroorganisme.
B. Rumusan Masalah
Adapun permasalahan dari makalah ini yaitu:
- Jenis mikroorganisme apakah yang mampu menghasilkan enzim lipase?
- Bagaimanakah cara memproduksi enzim lipase dari mikroba?
- Bagaimanakah cara pemurnian enzim lipase?
- Bagaimana cara mengkarakterisasi enzim lipase?
- Bagaimanakah cara menguji aktivitas enzim lpase?
C. Tujuan
Tujuan yang ingin dicapai dari pembuatan makalah ini yaitu:
- Mengetahui jenis mikroba penghasil enzim lipase.
- Mengetahui cara memproduksi enzim lipase dari mikroba.
- Mengetahui cara pemurnian enzim lipase.
- Mengetahui cara mengkarakterisasi enzim lipase.
- Mengetahui cara menguji aktivitas enzim lpase.
D. Manfaat
Manfaat yang dapat diperoleh dari makalah ini ialah kita dapat mengetahui jenis mikroba penghasil enzim lipase, cara memproduksi enzim lipase dari mikroba, cara mengkarakterisasi enzim lipase, dan mengetahui cara menguji aktivitas enzim lipase.
BAB 2. KAJIAN PUSTAKA
Dewasa ini, enzim adalah senyawa yang umum digunakan dalam proses produksi. Enzim yang digunakan pada umumnya berasal dari enzim yang diisolasi dari bakteri. Penggunaan enzim dalam proses produksi dapat meningkatkan efisiensi yang kemudian akan meningkatkan jumlah produksi.
Lipase (triacylglycerol hydrolase, E.C. 3.1.1.3) merupakan enzim yang penting pada industri lemak dan minyak, yaitu untuk mengubah bentuk fisik dan kimia minyak dan lemak alami menjadi produk yang bernilai tambah lebih tinggi (Elisabeth dan Siahaan, 2000, Ronne, T.H., et.al., 2005, Wang, et.al., 2006, Liu, et.al., 2007) sebagai contoh yang telah berhasil dengan baik yaitu modifikasi minyak dari tumbuhan menjadi lemak kakao subtitusi yaitu minyak sawit dengan stearin kelapa sawit, ataupun dengan mengganti sebagian dengan lemak sapi, minyak bunga matahari yang dilakukan secara interesterifikasi enzimatis (Macrae, 1983; Forssell, et.al., 1992; Bloomer, et.al., 1990; Khumalo, et.al., 2002).
Pemanfaatan enzim lipase di dalam industri pangan maupun non pangan semakin meningkat. Pada industri pangan, lipase banyak digunakan dalam industri susu (hidrolisis lemak susu), industri roti dan kue (meningkatkan aroma dan memperpanjang umur simpan), industri bir (meningkatkan aroma dan mempercepat fermentasi), industri bumbu (meningkatkan kualitas/tekstur), serta pengolahan daging dan ikan (meningkatkan aroma dan mengubah lemak). Sedangkan pada industri non pangan, lipase digunakan pada industri kimia dan obat-obatan (transesterifikasi minyak alami), industri oleokimia (hidrolisis lemak/minyak), industri detergen (melarutkan spot minyak/lemak), industri obat-obatan (mempermudah daya cerna minyak/lemak dalam pangan), kedokteran (analisis trigliserida dalam darah), industri kosmetik (mengubah lemak), dan industri kulit (mengubah lemak dalam jaringan lemak). Pemanfaatan lipase pada industri lemak dan minyak untuk mengubah bentuk fisik dan kimia minyak dan lemak alami menjadi produk yang bernilai tambah lebih tinggi (Khumalo, et.al., 2002).
Lipase diklasifikasikan sebagai enzim hidrolase yang menghidrolisis trigliserida menjadi asam lemak bebas, gliserida parsial (monogliserida), digliserida dan gliserida (Macrae, 1983). Aplikasi lipase untuk hidrolisis, interesterifikasi dan esterifikasi telah menjadi objek penelitian, dengan perhatian utama pada aplikasi minyak dan lemak. Lipase dapat digunakan dengan baik sebagai biokatalis dalam proses biologis (Dosanjh and Kaur, 2002).
Lipid terstruktur adalah triasil gliserol yang mengandung campuran asam lemak berantai pendek, medium, atau keduanya dan berantai panjang yang sebaiknya dalam molekul gliserol yang sama supaya menunjukkan potensi maksimalnya (Akoh, 1988). Lipid terstruktur berdasarkan lokasi asam lemak dibedakan menjadi lipid terstruktur spesifik (LSS) dan lipid terstruktur non-spesifik (LS). LS adalah minyak dan lemak termodifikasi atau sintetik mengandung asam lemak berantai panjang dan medium atau pendek. LSS adalah minyak dan lemak termodifikasi atau sintetik mengandung asam lemak berantai panjang dan medium atau pendek, dimana masing-masing kelompok menempati secara spesifik pada posisi sn-2 atau sn-1,3 dari kerangka gliserol. LS dapat diproduksi dengan interesterifikasi kimia (randominisasi) atau enzimatik. Namun LSS hanya dapat diproduksi melalui interesterifikasi enzimatik menggunakan enzim lipase regiospesifik (Xu, 2000). Pada akhir-akhir ini produk baru berupa LSS memperoleh perhatian dunia di bidang teknologi pangan dan gizi. Bahkan sintesis LSS dapat melalui ester asam lemak misalnya metil atau etil ester asam lemak yang dapat digunakan pula untuk biodiesel atau bahan baku industri oleokimia.
BAB 3. PEMBAHASAN
A. Lipase
Enzim lipase atau asilgliserol hidrolase (E.C 3.1.1.3) merupakan enzim yang dapat menghidrolisis rantai panjang trigliserida. Keterangan dari kode enzim ini adalah :
3 Hydrolases
1 Acting on ester bonds
1 Carboxylic-ester hydrolases
3 triacylglycerol lipase
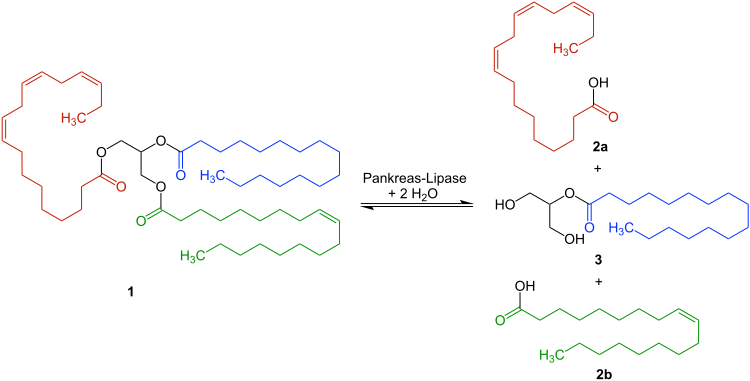
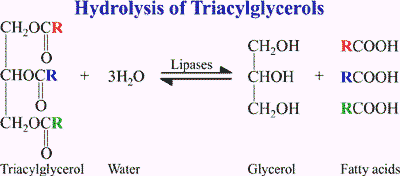
Enzim ini memiliki potensi untuk digunakan memproduksi asam lemak, yang merupakan prekursor berbagai industri kimia. Lipase diklasifikasikan sebagai enzim hidrolase yang menghidrolisis trigliserida menjadi asam lemak bebas, gliserida parsial (monogliserida), digliserida dan gliserida seperti pada gambar berikut.
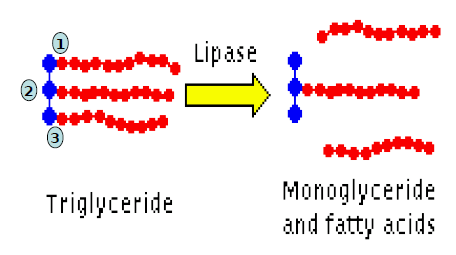
Produksi asam lemak secara industri menggunakan katalis kimia menghasilkan efek samping bagi lingkungan. Selain itu enzim lipase telah banyak dikenal memiliki cakupan aplikasi yang amat luas dalam bidang bioteknologi, seperti biomedikal, pestisida, pengolahan limbah, industri makanan, biosensor, detergen, untuk industri kulit dan industri oleokimia (memproduksi asam lemak dan turunannya).
Lipase sebagai katalis untuk reaksi esterifikasi dapat diperoleh dari species mikrobia ataupun tanaman. Nelson dkk. (1996) melakukan ”screening” lipase dari banyak spesies mikroba dalam kemampuannya melakukan transesterifikasi trigleserida dengan alkohol rantai pendek menjadi alkil ester. Lipase Mucor miehei ternyata paling efisien mengubah trigliserida menjadi alkil ester dengan alkohol primer, sedangkan lipase dari Candida antartica paling efisien untuk transesterifikasi trigliserida dengan alkohol sekunder menghasilkan alkohol ester bercabang. Lipase ini juga terbukti efektif untuk transesterifikasi minyak nabati dan bahan baku lain yang mengandung asam lemak tinggi menjadi derivat alkil ester.
B. Sisi aktif enzim lipase
Lipase juga disebut dengan serin hidrolase yang bekerja pada urutan G-X1-S-X2-G, dimana G-glycine, S-serine, X1-histidin dan X2-asam glutamat atau aspartat. Fungsi biologis dari lipase adalah mengkatalisis proses hidrolisis dari triacylglycerols menjadi asam lemak bebas. Gambar beikut dapat dilihat struktur 3 dimensi dari enzim lipase.
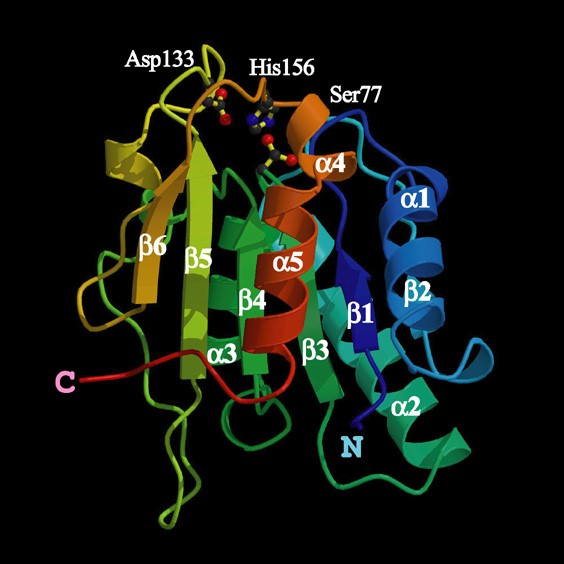
Dari gambar diatas dapat dilihat komponen sisi aktiv dari enzim lipase yang teridiri dari Serin-77, Aspartat-133 dan Histidin-156. Berikut adalah struktur dari asam amino serin, aspartat dan histidin.
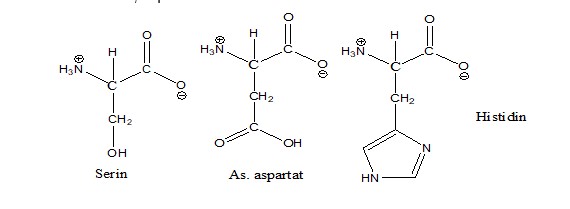
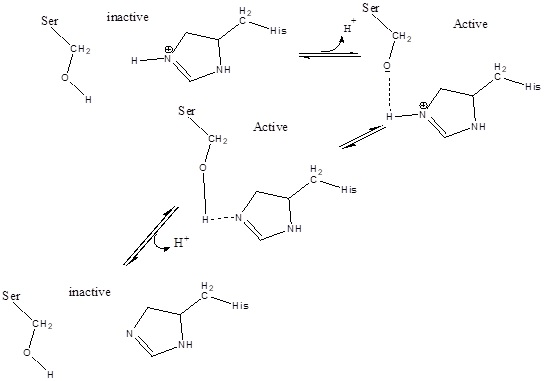
Interaksi residu Asp atau Glu bermuatan negatif memungkinkan residu tersebut untuk bertindak sebagai basis umum yang dapat menangkap sebuah proton dari gugus hidroksil situs aktif Serin. Sehingga dihasilkan ion alkoksida yang nukleofilik terhadap residu Serin untuk menyerang gugus karbonil substrat ester membentuk perantara asil-enzim. Komponen penting lainnya untuk mekanisme katalitik adalah oxyanion-hole yang terdiri dari donor ikatan H (kebanyakan ikatan kelompok N-H). Lubang oxyanion membantu untuk menstabilkan reaksi antara selama katalisis ketika oksigen karbonil membawa muatan parsial negatif.
Proses aktivasi serin oleh histidin dan asp/glu lipase dapat digambarkan seperti dibawah ini.
C. Mekanisme Hidrolisis Triasilgliserol
Secara umum proses pemutusan ikatan ester oleh lipase dapat digambarkan seperti berikut ini.
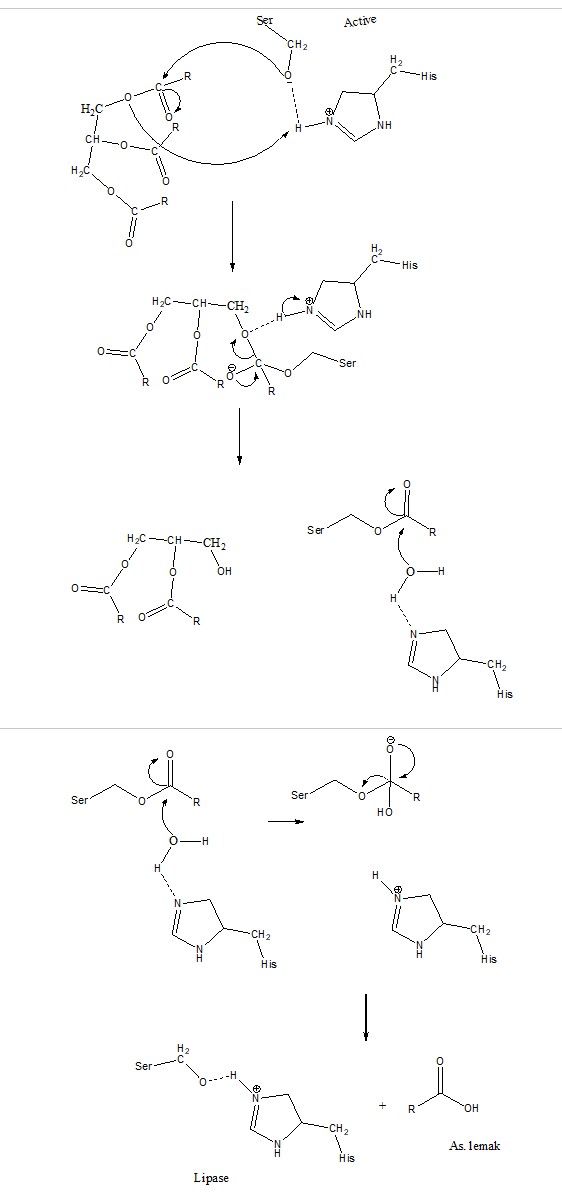
Dari gambar di atas maka dapat kami tuliskan mekanisme reaksi dari hidrolisis triasilgliserol secara umum seperti berikut ini.
D. Mikroorganisme penghasil enzim lipase
Kelompok yeast yang dapat manghasilkan lipase adalah dari Candida rugosa dan dari kelompok jamur adalah Aspergillus niger dan Penicillium aurantiogriseum. Adapun pada kelompok bakteri, lipase yang dihasilkan adalah dari genera Bacillus, Aeromonas, Pseudomonas, Alcaligenes, Arthrobacter, Chromobacterium, Serratia, Vibrio, Aeromonas, dan Staphyloccus.
Di antara sumber lipase baik berasal dari tumbuhan, hewan dan mikroba, ternyata lipase mikroba yang paling banyak digunakan. Hal ini disebabkan karena mikroba dapat dengan mudah dibudidayakan dan lipase dapat mengkatalis berbagai reaksi hidrolisis dan sintetis. Lipase digunakan dalam berbagai bidang bioteknologi, seperti pengolahan makanan dan susu (keju pematangan, pengembangan rasa, EMC teknologi), deterjen, farmasi (naproxen, ibuprofen), agrokimia (insektisida, pestisida) dan oleokimia (hidrolisis lemak dan minyak, sintesis biosurfaktan ) industri. Lipase dapat lebih dimanfaatkan di daerah baru di mana mereka dapat berfungsi sebagai biocatalysts potensial.
Lipase yang dihasilkan bakteri dipengaruhi oleh beberapa faktor, salah satunya adalah lama waktu inkubasi. Lama waktu inkubasi mempengaruhi jumlah lipase yang dihasilkan. Kemampuan bakteri dalam menghasilkan lipase telah ditemukan dengan lama waktu inkubasi dari beberapa jam sampai beberapa hari. Pabai et al (1996) dan Dong et al (1999) melaporkan bahwa Pseudomonas spp., P. fragi, dan P. fluorescens BW 96CC mampu menghasilkan lipase hingga mencapai maksimum setelah inkubasi antara 72 dan 96 jam. Menurut Mahadik et al (2002), aktivitas lipase Aspergillus niger maksimum pada waktu inkubasi 5 hari. Lima et al. (2005) melaporkan bahwa jamur Penicillium aurantiogriseum menghasilkan lipase setelah inkubasi 48 dan 72 jam.
1. Lipase Bakteri
Sejumlah relatif lebih kecil dari lipase bakteri telah diteliti dengan baik dibandingkan dengan tanaman dan jamur lipase. Lipase bakteri adalah glikoprotein, tetapi beberapa lipase bakteri ekstraseluler adalah lipoprotein. Winkler et al melaporkan bahwa produksi enzim pada sebagian besar bakteri dipengaruhi oleh polisakarida tertentu. Sebagian besar lipase bakteri dilaporkan sejauh ini konstitutif dan tidak spesifik dalam spesifisitas substrat dan lipase bakteri sedikit thermostabil.
Di antara bakteri Achromobacter sp., Alcaligenes sp., Arthrobacter sp., Pseudomonas sp, Staphylococcus sp dan Chromobacterium sp, telah dimanfaatkan dalam produksi enzim lipase. Stafilokokus menghasilkan lipoprotein lipase di alam. Lipase dimurnikan dari S. aureus dan S. hyicus menunjukkan berat molekul berkisar antara 34-46 kDa. Mereka dirangsang oleh Ca2+ dan dihambat oleh EDTA. pH optimum bervariasi antara 7,5 dan 9,0. gen lipase dari S. hyicus dan S. aureus telah diklon, diurutkan, dan dibandingkan dengan lipase lainnya. Ke-duanya menunjukkan adanya domain terpisah oleh 100 jenis residu asam amino yang mungkin untuk membentuk sisi aktif. Residu situs putatif aktif terdapat pada His 269 dan Ser 369, pada lipase S. hyicus sangat dilestarikan dalam dua lipase S. aureus dan dalam lipase beberapa eukariot.
Lipase dari spesies yang berbeda dari Psuedonomas telah dimurnikan dengan pengasaman dari supernatan kultur, pengendapan amonium sulfat, kromatografi kolom, dan fokus isoelektrik menggunakan CHAPS. Lipase yang dimurnikan dari P. fragi, P. fluorescens, dan P. aeruginosa monomer dengan berat molekul 33 kDa, 45 kDa, dan 29 kDa. Lipase ini dihambat oleh Zn++, Fe++, dan Al+++ dan activator oleh Ca++. Gen lipase dari P. fragi telah dikloning dan sequenced.
2. Lipase jamur
Lipase jamur telah diteliti sejak tahun 1950-an, dan Lawrence, Brockerhoff dan Jensen telah menyajikan tinjauan yang komprehensif. Lipase ini sedang dieksploitasi karena biaya ekstraksi yang rendah, stabilitas termal dan pH, spesifisitas substrat, dan aktivitas dalam pelarut organik. Para produsen utama dari lipase komersial ialah Aspergillus niger, Candida cylindracea, lanuginosa Humicola, Mucor miehei, Rhizopus arrhizus, R. delemar, R. japonicus, R. niveus dan R. oryzae.
Di antara Mucorales, enzim lipolitik dari Mucor hiemalis , M. miehei, M. lipolyticus, M. pusillus, Rhizopus japonicus, R. arrhizus, R. delemar. R. nigricans, R. nodosus, R. microsporus, dan R. chinesis telah dipelajari secara detail. Termofilik M. pusillus dikenal sebagai penghasil lipase ekstraseluler termostabil.
1,3 – spesifisitas (regio)-dari Rhizopus, merupakan lipase yang sangat cocok untuk konversi trigliserida menjadi monogliserida. Lipase R. japonicus telah digunakan untuk menghasilkan mentega, pembuatan coklat dan interesterifikasi minyak sawit dengan metil stearate. Lipase (40 sampai 45 kDa) dari berbagai jenis Rhizopus menunjukkan aktivitas maksimum terhadap asam lemak rantai menengah (C8-C10). Dalam kasus R. delemar, ekstraseluler dan intraseluler isoenzim lipase telah diisolasi.
Produsen Lipase dari Entomophthorales termasuk Entomophthora apiculata, E. coronata, E. thaxteriana, E. virulenta, Basidiobolus spp. dan Conidiobolus spp. Untuk genus Pichia, Hansenula, dan Saccharomyces juga dilaporkan menghasilkan lipase. Dua macam lipase telah dimurnikan dari Saccharomyces lipolytica. Lipase dilaporkan dari Candida curvata, C. tropicalis, C. valida, dan C. pellioculosa dan spesifik terhadap obligasi ester berbeda dalam hidrolisis trigliserida dengan C. deformans.
Jamur Geotrichum candidum berperan dalam pembentukan asam dalam produk susu oleh lipolyzing lemak. Lipase dari G. candidum spesifisitas terhadap asam lemak dengan ikatan rangkap cis di C9, sehingga enzim ini diterapkan untuk analisis struktural triglycerides.
Enzim lipase intraseluler dan ekstraseluler Aspergillus niger adalah 1,3 – (regio)-specific. A. oryzae dilaporkan efisien untuk ekspresi heterolog dari lipase dari Rhizopus miehei dan Humicola lanuginosa. Enzim lipase dari Penicillium roqueforti berperan dalam rasa Blue cheese. Aktivitas lipolitik juga telah terdeteksi pada P. camemberti, permukaan cetakan putih dan keju Brie Camembert. Lipase dengan spesifisitas untuk asam butirat telah diisolasi dari strain dari spesies Penicillium seperti P. cyclopium, P. Verrucosum var, P. cyclopium, dan P. crustosum. Enzim lipase dari P. cyclopium memiliki aktivitas yang jauh lebih tinggi terhadap mono dan digliserida selain trigliserida. Enzim lipase dari H. lanuginosa DSM 3819 cocok sebagai aditif deterjen karena bersifat termostabilitas, aktivitas yang tinggi pada pH basa, dan stabilitas terhadap surfactant anionik. Lipase dari H. lanuginosa menunjukkan tingkat tinggi aktivitas hidrolitik pada minyak kelapa dan minyak karena memiliki kandungan asam laurat yang tinggi.
E. Produksi dan Pemurnian Enzim Lipase dari Bakteri
Produksi enzim lipase dari bakteri diawali dengan penanaman bakteri dalam media fermentasi yang terdiri dari komposisi gum arab 5%, pepton 1%, , minyak zaitun 10% dengan kondisi optimum pertumbuhan bakteri sebagai berikut: waktu inkubasi 24 jam, suhu 35°C, pH 8 (Anissa, 2006). Penanaman media fermentasi menggunakan kondisi optimum dilakukan untuk memperoleh enzim lipase dengan jumlah yang cukup besar.
Setelah diinkubasi dalam media fermentasi selama 24 jam, enzim lipase dipisahkan dengan menggunakan alat sentrifuga dengan kecepatan 3500 rpm, 30 menit dan suhu 4oC untuk mendapatkan ekstrak kasar enzim lipase. Dari proses ini diperoleh ekstrak kasar enzim sebanyak 985 mL dengan aktivitas unit rata-rata enzim hasil pengukuran duplo 0,21 U/ml, kadar protein 3,55 mg/ml, aktivitas spesifik 0,059 U/mg.
Setelah didapat ekstrak kasar dilanjutkan dengan proses pemurnian enzim secara fraksinasi bertingkat menggunakan garam amonium sulfat. Fraksi tertinggi adalah fraksi ke V (80-100)% jenuh dengan aktivitas unit 3,5 U/ml, kadar protein 1,74 mg/ml dan aktivitas spesifik 2,011 U/mg. Fraksi tertinggi yang diperoleh ini selanjutnya didialisis menggunakan bufer fosfat pH 8; 0,025 M. Enzim lipase hasil dialisis fraksi ke V menunjukkan 2,04 U/ml, kadar protein 0,42 mg/ml.dan aktivitas spesifik 4,86 U/mg. Hasil ini memperlihatkan bahwa telah terjadi kenaikan sebesar 82,37 kali dibandingkan ekstrak kasar enzim dengan perolehan 31,48 %.
Enzim lipase yang telah didialisis selanjutnya dimurnikan kembali dengan sephadex G-100 secara kromatografi kolom, diperoleh 22 fraksi dimana fraksi 19 adalah fraksi tertinggi dengan aktivitas unit 2,83 U/ml, kadar protein 0,57 mg/ml dan aktivitas spesifik 4,96 U/mg.
Dari 3 tahap pemurnian (fraksinasi, dialisis, dan kromatografi kolom) terlihat bahwa aktivitas spesifik meningkat yang disebabkan oleh peningkatan kemurnian enzim. Aktivitas spesifik enzim dipengaruhi oleh kadar protein, semakin tinggi aktivitas spesifik suatu enzim maka semakin tinggi kemurnian enzim tersebut. Hal ini menunjukkan terjadinya pemisahan protein lain yang bukan enzim. Dengan meningkatnya aktivitas spesifik pada tiap tahap pemurnian, menunjukkan bahwa proses pemurnian yang dilakukan cukup baik.
F. Pemurnian Enzim
1. Fraksinasi Amonium Sulfat
Proses pemurnian sampel ekstrak kasar enzim lipase diawali dengan fraksinasi bertingkat menggunakan garam ammonium sulfat dengan tingkat kejenuhan (0-20%), (20-40%), (40-60%), (60-80%) dan 80-100%). Fraksinasi dengan amonium sulfat dilakukan dengan cara menambahkan amonium sulfat sedikit demi sedikit pada larutan ekstrak kasar enzim sambil diaduk dengan pengaduk magnet. Pengadukan diusahakan sedemikian rupa sehingga tidak menimbulkan busa selama kurang lebih 20 menit. Setiap endapan protein enzim yang didapat dipisahkan dari filtratnya dengan menggunakan sentrifugasi pada kecepatan 5000 rpm selama 15 menit kemudian dilarutkan dalam larutan buffer fosfat pH 8 dengan konsentrasi 0,05 M lalu diuji aktivitasnya menggunakan Metode titrimetri dan ditentukan kadar proteinnya menggunakan Metode Lowry. Fraksi yang memberi aktivitas tertinggi diuji aktivitas esterifikasinya.
2. Dialisis
Endapan enzim hasil fraksinasi bertingkat yang memiliki aktivitas tertinggi dilarutkan ke dalam buffer fosfat pH 8; 0,05 M selanjutnya dimasukkan kedalam kantong selofan, kemudian didialisis menggunakan buffer fosfat pH 8; 0,05 M selama ± 48 jam pada suhu 4ºC.
3. Kromatografi Kolom
Perlakuan enzim selanjutnya adalah pemurnian berdasarkan ukuran dengan kolom kromatografi filtrasi gel menggunakan sephadex G-100 sebagai fase diam. Sampel diteteskan pada bagian atas kolom gel sephadex G-100 yang berfungsi sebagai fase diam dan larutan buffer fosfat pH 8 yang berfungsi sebagai fase gerak. Sampel enzim yang memiliki bobot molekul lebih besar dari pori-pori gel akan melewati ruang antar pori-pori sehingga akan lebih dahulu keluar dari kolom sebaliknya yang berbobot molekul lebih kecil akan masuk ke dalam pori-pori matriks sehingga akan keluar lebih lambat. Setelah proses kolom berlangsung, eluen ditampung pada wadah sebesar 15 ml. Eluen yang telah ditampung pada wadah kemudian diukur kadar protein dan aktivitas enzimnya. Fraksi yang memberikan aktivitas tinggi dikumpulkan dan dikarakterisasi serta ditentukan aktivitas esterifikasinya.
G. Uji aktivitas enzim lipase
Untuk menentukan aktivitas enzim menggunakan metode titrimetri yaitu, sebanyak 2 ml minyak zaitun dalam erlenmeyer 100 ml, ditambah 1 ml buffer fosfat 0,05 M (pH 8), dan 1 ml larutan enzim. Campuran substrat enzim ini kemudian dikocok menggunakan shaker inkubator pada 30°C selama 1 jam. Setelah 1 jam substrat enzim diinaktifkan dengan menggunakan campuran aseton : etanol (1:1) sebanyak 1 ml. Campuran tersebut ditambahkan 5 tetes fenolftalein 1% sebagai indikator dan dititrasi dengan menggunakan larutan NaOH 0,05 N. Titrasi dihentikan setelah campuran berubah menjadi merah muda. Pengukuran aktivitas dilakukan secara duplo. Untuk penetuan standar dilakukan dengan komposisi campuran yang sama, tetapi pada saat dimasukkan larutan enzim dengan segera ditambahkan campuran aseton : etanol untuk menginaktifkan enzim. Kemudian dititrasi dengan prosedur yang sama dengan analisis sampel.
H. Penentuan Kadar Protein
Sebanyak 0,1 ml larutan enzim ditambahkan 0,9 ml aquades direaksikan dengan 5 ml larutan C. Larutan didiamkan selama 10 menit pada suhu kamar, kemudian ditambahkan reagen Folin-Ciocelteau sebanyak 0,5 ml. Larutan dibiarkan selama 30 menit pada suhu kamar. Warna yang terbentuk dibaca serapannya pada panjang gelombang 740 nm dengan menggunakan spektrofotometer UV-Vis. Konsentrasi protein ditentukan dengan menggunakan kurva standar Bovin serum Albumin (BSA) dengan konsentrasi 0-800 ppm.
I. Uji Aktivitas Esterifikasi
Pengukuran aktivitas esterifikasi dilakukan menggunakan Metode Hariyadi (1995) dalam Efendi (2001) yaitu dengan cara mengesterkan 0,2 M asam laurat dan 0,2 M lauril alkohol didalam tabung reaksi bertutup, masing-masing sebanyak 5 ml. Selanjutnya di inkubasi pada suhu 50°C selama 15 menit. Setelah suhu konstan, ditambahkan enzim sebanyak 0,1 ml kemudian diinkubasi selama 15 menit pada suhu 50°C. Selama reaksi esterifikasi berlangsung dilakukan pengadukan dengan stirer agar reaksi berjalan lebih baik. Untuk mempertahankan suhu yang konstan, esterifikasi dilakukan menggunakan circulated water bath. Media pemanas yang digunakan adalah aliran air yang terus berputar secara kontinyu (Nuraida, 2000 dan Suhendra, 2004).
Setelah reaksi esterifikasi selesai, hasil reaksi segera disaring dengan membran selulosa 0,45 μm untuk memisahkan enzim. Filtrat yang telah terpisah dari enzim, dianalisis kandungan asam lemak bebas (ALB).
Untuk pengukuran asam lemak bebas menggunakan Metode Lowry dan Tinsley yang dimodifikasi. Filtrat yang diperoleh diambil sebanyak 0,4 ml dan dimasukkan kedalam tabung reaksi kemudian ditambahkan 4,6 ml heksan. Setelah itu dihomogenkan menggunakan vortex 30 detik yang dilanjutkan dengan penambahan 1 ml cupric asetat pH 6-6,2 sebagai pewarna. Kemudian dihomogenkan kembali selama 2 menit dan diinkubasikan selama 15 menit. Lapisan atas filtrat diambil dan diukur absorbansinya pada panjang gelombang 715 nm. (kurva standar dibuat dengan menggunakan asam laurat 0-100 mmol).
J. Karakterisasi Enzim
Fraksi yang digunakan untuk tahap karakterisasi enzim adalah fraksi yang mempunyai aktivitas unit tertinggi. Selanjutnya dilakukan karakterisasi enzim yang meliputi pH, temperatur, waktu inkubasi, Km dan Vm.
1. pH Optimum
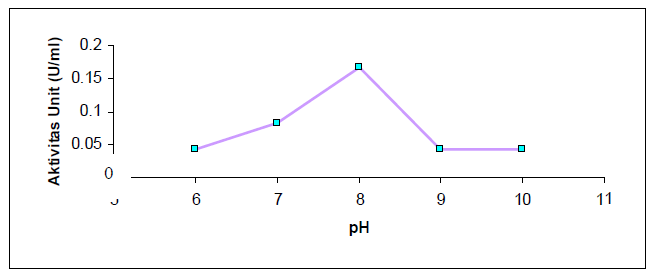
Untuk menentukan pH optimum enzim hasil isolasi, variasi pH yang digunakan adalah 6, 7, 8, 9, dan 10 hasilnya tertera pada Gambar 1. Dari gambar tersebut terlihat bahwa aktivitas lipase bervariasi dengan adanya perubahan pH. Hal ini umumnya terjadi karena adanya perubahan struktur sekunder dan tersier dari enzim. Pada pH yang optimum muatan gugus samping asam amino berada pada keadaan yang sesuai sehingga enzim sangat efisien dalam mempercepat reaksi biokimia yang sangat spesifik. Aktivitas optimum lipase dicapai pada pH 8. Hal ini disebabkan karena pada kondisi pH 8 gugus pemberi dan penerima proton yang penting pada sisi katalitik enzim berada pada keadaan yang diinginkan sehingga aktivitas katalitiknya tinggi.
2. Penentuan Temperatur optimum
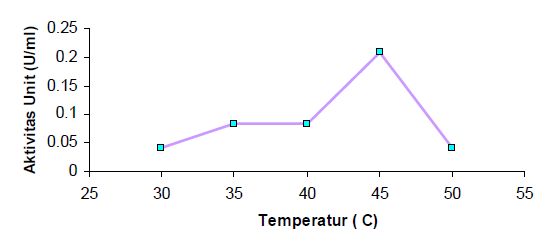
Pada penentuan temperatur optimum, suhu yang digunakan adalah 30°C, 35°C, 40°C, 45°C, dan 50°C. Dari hasil pengujian yang dilakukan temperatur optimum lipase adalah 45°C seperti yang tertera pada Gambar 2. Pada temperatur kurang dari 45°C enzim cukup stabil, tetapi hidrolisis substrat minyak zaitun oleh enzim tidak berjalan secara maksimal. Dengan meningkatnya temperatur, energi kinetik molekul-molekul yang bereaksi bertambah sehingga molekul yang bereaksi semakin banyak dan produk yang dihasilkan semakin besar. Diatas temperatur optimum, aktivitas enzim menurun tajam hal ini terjadi karena enzim mengalami denaturasi protein yang dapat merubah konformasi struktur molekul sehingga enzim kehilangan sifat alamiahnya. Pada temperatur tinggi, substrat juga dapat mengalami perubahan konformasi sehingga gugus reaktifnya mengalami hambatan dalam memasuki sisi aktif enzim (Suhartono, 1989). Sedangkan pada suhu yang lebih rendah dari suhu optimum, aktivitas enzim juga rendah. Hal ini disebabkan karena rendahnya energi aktivasi yang tersedia. Energi tersebut dibutuhkan untuk menciptakan kondisi tingkat kompleks aktif, baik dari molekul enzim atau molekul substrat.
3. Waktu Inkubasi optimum
Selain pH dan temperatur, waktu inkubasi juga mempengaruhi pembentukan produk. Penentuan waktu inkubasi optimum dilakukan dengan pengujian enzim lipase pada berbagai waktu inkubasi, yaitu : 5, 10, 15, 20, 25, dan 30 menit. Pengaruh waktu inkubasi terhadap aktivitas enzim lipase dapat dilihat pada Gambar berikut.
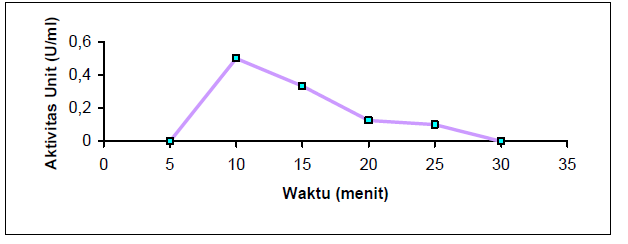
Berdasarkan pada Gambar diatas, aktivitas lipase optimum pada waktu inkubasi 10 menit. Pada waktu inkubasi diatas 10 menit, enzim mulai mengalami penurunan aktivitas lipase. Hal ini dapat disebabkan adanya perbedaan waktu yang dibutuhkan oleh setiap enzim untuk bereaksi dengan substrat. Selain itu dengan panas 45°C enzim lipase tidak dapat terlalu lama bereaksi dengan substrat sehingga lipase mulai mengalami denaturasi.
4. Nilai Km dan Vm
Kecepatan reaksi enzim akan meningkat seiring dengan meningkatnya konsentrasi substrat sampai pada suatu harga yang memberikan kecepatan reaksi tetap. Pada keadaan tersebut, kecepatan reaksi enzim mencapai maksimum karena reaksi enzim dengan substratnya menjadi jenuh dan tidak dapat bereaksi lebih cepat. Harga KM dari suatu enzim berfungsi untuk mengetahui konsentrasi dari substrat yang menghasilkan setengah laju reaksi maksimum.
Dari Gambar 4 dapat dilihat bahwa mula-mula aktivitas unit meningkat dengan bertambahnya konsentrasi substrat, akan tetapi setelah tercapai aktivitas optimum terjadi penurunan aktivitas. Hal ini dikarenakan pada konsentrasi substrat optimum enzim berada pada keadaan “jenuh dengan substrat”. Selain itu, dapat juga disebabkan pengendalian umpan balik, dimana jika produk yang dihasilkan berlebih maka produk tersebut menjadi inhibisi bagi kerja enzim.
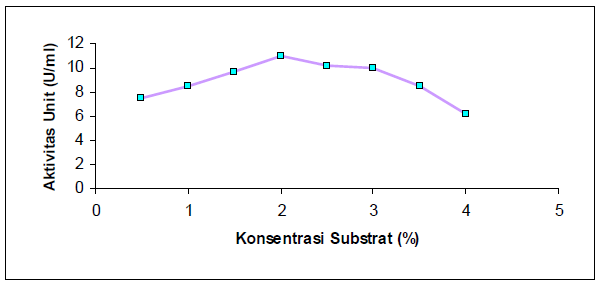
Harga KM dihitung dengan mengukur aktivitas enzim lipase dalam berbagai konsentrasi substrat dengan pH, temperatur, dan waktu inkubasi optimum. Pada penelitian ini digunakan pH 8, temperatur 45°C, dan waktu inkubasi 10 menit. Harga KM enzim hasil isolasi adalah 0,07 mg substrat/ml dan Vmaks sebesar 1,506 μmol minyak/ml enzim.menit.
K. Uji Aktivitas Esterifikasi
Penentuan aktivitas esterifikasi dilakukan dengan mencampurkan asam laurat dan lauril alkohol sehingga akan dihasilkan ester dan air. Selain itu dalam penelitian ini juga digunakan pelarut heksana. Heksana merupakan pelarut organik non polar yang sering dan cocok digunakan dalam reaksi esterifikasi yang dikatalis oleh lipase. Selain itu menurut Basri et al.,(1995) aktivitas esterifikasi yang tinggi dari enzim lipase diperoleh dengan menggunakan pelarut organik yang bersifat non polar karena pada pelarut hidrofobik, air cenderung akan berpartisi ke dalam molekul enzim sehingga akan meningkatkan kelarutan dan kestabilan enzim. Sementara itu aktivitasnya akan rendah pada penggunaan pelarut organik yang bersifat polar karena pelarut tersebut akan menarik sebagian air esensial dari molekul enzim.
Dalam pengujian aktivitas esterifikasi dilakukan pada ekstrak kasar enzim, fraksi tertinggi ( Fraksi V) dari fraksinasi amonium sulfat, enzim hasil dialisis, dan enzim hasil kromatografi kolom. Dari hasil penelitian diperoleh data bahwa aktivitas esterifikasi meningkat dari ekstrak kasar enzim sampai tahap pemurnian kromatografi kolom seperti yang terlihat pada Tabel 1.
Dari Tabel 1 dapat dilihat bahwa aktivitas esterifikasi dari ekstrak kasar sampai dengan kromatografi kolom semakin meningkat. Hal ini dapat disebabkan semakin meningkat kemurnian enzim lipase maka makin meningkat juga aktivitas esterifikasi enzim lipase.
Tabel 1. Hasil Uji Aktivitas Esterifikasi Lipase
| Tahap | Aktivitas esterifikasi
(mmol/ml enzim.menit) |
| Ekstrak kasar enzim | 2.38 |
| Fraksi V (80-100%) | 3.81 |
| Dialisis | 4.29 |
| Kromatografi kolom | 5.24 |
Adanya protein lain yang bukan enzim dapat menghambat sehingga kerja enzim tidak maksimal dalam proses esterifikasi. Maka ketika dilakukan pemurnian, enzim telah terpisah dari protein lain yang bukan enzim sehingga dapat memaksimalkan proses esterifikasi.
L. Aplikasi / Pemanfaatan enzim lipase
1. Lipase dalam industri susu
Lipase digunakan secara ekstensif dalam industri susu untuk hidrolisis lemak susu. Aplikasi saat ini meliputi peningkatan rasa keju, percepatan pematangan keju, pembuatan produk keju-suka, dan lipolisis lemak mentega, dan cream. Sedangkan penambahan lipase terutama lisis rantai pendek (C4 dan C6) asam lemak yang mengarah ke pengembangan rasa, aroma tajam, pelepasan rantai menengah (C12 dan C14) asam lemak cenderung memberikan rasa sabun untuk produk . Selain itu, asam lemak bebas mengambil bagian dalam reaksi kimia sederhana di mana mereka memulai sintesis bahan rasa lain seperti aceto-asetat, ß-keto asam, metil keton, ester rasa, dan lactones.
2. Lipase dalam deterjen
Penggunaan enzim dalam sabun bubuk masih tetap menjadi pemasaran terbesar untuk industri enzyme. Tren di seluruh dunia terhadap suhu pencucian yang lebih rendah telah menyebabkan permintaan jauh lebih tinggi untuk formulasi deterjen rumah tangga. program skrining terakhir intensif, diikuti oleh manipulasi genetik, telah menghasilkan pengenalan beberapa persiapan yang cocok, misalnya, Novo Nordisk’s Lipolase (lipase Humicola disajikan dalam Aspergillus oryzae).
3. Lipase di industri oleokimia
Ruang lingkup penerapan lipase pada industri oleokimia sangat besar karena menghemat energi dan meminimalkan degradasi termal selama hidrolisis, glycerolysis, dan alcoholysis. Miyoshi Minyak dan Lemak.Co Jepang, melaporkan penggunaan komersial cylindracea lipase Candida dalam produksi sabun. Pengenalan generasi baru enzim murah dan sangat termostabil dapat mengubah keseimbangan ekonomi yang mendukung penggunaan lipase.
Kecenderungan saat ini di industri oleokimia adalah suatu gerakan menjauh dari menggunakan pelarut organik dan emulsifiers. Berbagai reaksi yang melibatkan hidrolisis, alkoholisis, dan glycerolysis telah dilakukan langsung dalam campuran substrat menggunakan berbagai lipase amobil. Ini telah menghasilkan produktivitas yang tinggi serta terus menerus menjalankan proses. Hidrolisis enzimatis mungkin menawarkan harapan terbesar untuk membelah lemak tanpa investasi yang besar dalam peralatan mahal serta pengeluaran dalam jumlah besar energy termal.
4. Lipase dalam sintesis trigliserida
Nilai komersial lemak tergantung pada komposisi asam lemak dalam struktur mereka. Sebuah contoh khas dari campuran trigliserida tinggi nilai-asimetris adalah mentega kakao. Potensi lipase 1,3-regiospecific untuk pembuatan pengganti mentega, coklat diakui oleh Unilever dan Fuji Oil. Ulasan komprehensif pada teknologi ini, termasuk analisis komposisi produk yang ditemukan. Pada prinsipnya, pendekatan yang sama berlaku untuk sintesis banyak lainnya terstruktur triglycerides properti memiliki dietic atau nutrisi yang berharga, lemak misalnya, susu manusia. Ini trigliserida dan lemak fungsional serupa mudah diperoleh dengan acidolysis dari fraksi minyak kelapa sawit yang kaya 2-palmitoil gliserol dengan asam lemak tak jenuh (s). Acidolysis, dikatalisis oleh lipase 1,3-spesifik, digunakan dalam penyusunan produk nutrisi penting yang umumnya mengandung lemak rantai asam menengah. Lipase sedang diselidiki secara ekstensif sehubungan dengan modifikasi minyak bernilai tinggi asam lemak tak jenuh ganda seperti asam arakidonat, asam eicosapentaenoic, dan asam docosahexaenoic. Pengayaan substansial di kandungan asam lemak tak jenuh ganda fraksi mono-gliserida telah dicapai oleh alkoholisis lipase-katalis atau hydrolysis.
5. Lipase dalam sintesis surfaktan
Poligliserol dan karbohidrat ester asam lemak banyak digunakan sebagai detergen industri dan sebagai pengemulsi dalam berbagai besar formulasi makanan (spread yang rendah lemak, saus, es krim, mayonnaises). Enzymic sintesis surfaktan fungsional yang sama telah dilakukan pada suhu sedang (60-80 ° C) dengan regioselectivity sangat baik. Adelhorst et al telah melakukan esterifikasi pelarut-bebas dari sederhana alkil-glikosida menggunakan asam lemak cair dan lipase amobil antarctica Candida. Fregapane et al diperoleh mono-dan di-esters dari monosakarida dalam hasil tinggi, menggunakan asetal gula sebagai bahan awal. Lipase dari A. terreus mensintesis biosurfaktan oleh transesterifikasi antara minyak alami dan gula alcohol. Lipase juga dapat mengganti phospholipases dalam produksi lysophospholipids. Lipase Miehei Mucor telah digunakan untuk transesterifikasi fosfolipid dalam berbagai alcohol primer dan sekunder. Lipase juga mungkin berguna dalam sintesis berbagai macam surfaktan bio-degradable amfoter, ester asam amino yaitu berbasis, dan amides.
6. Lipase dalam sintesis bahan-bahan untuk produk perawatan pribadi
Unichem Internasional baru-baru ini meluncurkan produksi palmitat isopropyl miristat, isopropil, dan 2-ethylhexyl palmitate untuk digunakan sebagai emolien dalam produk perawatan pribadi seperti minyak kulit dan krim anti sinar matahari, dan sabun mandi. Ester Wax memiliki aplikasi serupa dalam produk perawatan pribadi dan sedang diproduksi secara enzimatis, menggunakan lipase C. cylindracea, dalam sebuah batch bioreactor.
7. Lipase di farmasi dan bahan kimia pertanian
Utilitas lipase dalam penyusunan synthons kiral baik diakui dan didokumentasikan. Beberapa proses baru saja dikomersialkan yang telah dijelaskan oleh Sainz-Diaz et al., dan Davis et al. Resolusi asam 2-halopropionic, bahan awal untuk sintesis herbisida phenoxypropionate, adalah proses berdasarkan esterifikasi selektif (S)-isomer dengan butanol, yang dikatalisis oleh lipase pankreas babi dalam hexane anhidrat. Contoh lain yang mengesankan dari aplikasi komersial lipase dalam resolusi campuran rasemat adalah hidrolisis epoxyester alcohol. Produk reaksi, ester (R)-glisidil dan (R)-glycidol dapat segera dikonversi ke (R) – dan (S)-glycidyltosylates yang intermediet menarik bagi penyusunan optik blocker ß aktif-dan berbagai macam produk lainnya . Sebuah teknologi yang sama telah dikomersialisasikan untuk menghasilkan 2 (R), glycidate 3 (S)-methylmethoxyphenyl, yang intermediate kunci dalam pembuatan obat kardiovaskular optik Diltiazem murni.
Lipase memiliki aplikasi sebagai katalis industri untuk resolusi alkohol rasemat dalam penyusunan beberapa prostaglandin, steroid, dan analog nukleosida carbocyclic. Regioselective modifikasi senyawa organik polifungsional daerah lain belum berkembang pesat aplikasi lipase, khususnya di bidang AIDS treatment. Lipase dari A. carneus dan A. terreus menunjukkan kemo-dan regiospecificity di hidrolisis peracetates dari farmasi penting polifenolik compounds. Lipase juga berguna dalam sintesis dari sucralose sweetner buatan oleh hidrolisis regioselective dari Octa-acetylsucrose.
8. Lipase dalam sintesis polimer
Stereoselektivitas lipase berguna untuk sintesis polymer optik aktif. Polimer ini adalah reagen asimetris, dan digunakan sebagai pernyerap. Di bidang kristal cair, monomer yang sesuai dapat dibuat dengan transesterifikasi lipase-katalis dari alcohol, yang dengan alkohol rasemat bisa disertai dengan resolution. Penggunaan glycidyltosylates kiral untuk persiapan crystal feroelektrik cair juga telah dilaporkan. Dengan demikian, enzim ini telah melakukan diversifikasi penggunaan komersial, baik dalam hal skala dan proses. Lipase telah bekerja dengan sukses di industri makanan serta teknologi tingkat tinggi dalam produksi bahan kimia dan farmasi. Selanjutnya, enzim ini memiliki potensi di bidang baru, untuk lipase misalnya telah berhasil telah digunakan dalam pembuatan kertas – ternyata, perlakuan pulp dengan lipase menghasilkan produk yang berkualitas tinggi dan kebutuhan pembersihan berkurang. Demikian pula, enzim juga telah digunakan dalam hubungan dengan koktail mikroba untuk pengobatan limbah lemak yang kaya dari pabrik es krim.
BAB 4. KESIMPULAN
Dari pembahasan dapat ditarik kesimpulan bahwa:
- Jenis mikroorganisme penghasil enzim lipase adalah Kelompok yeast dari Candida rugosa, kelompok jamur adalah Aspergillus niger dan Penicillium aurantiogriseum. Adapun pada kelompok bakteri, lipase yang dihasilkan adalah dari genera Bacillus, Aeromonas, Pseudomonas, Alcaligenes, Arthrobacter, Chromobacterium, Serratia, Vibrio, Aeromonas, dan Staphyloccus.
- Produksi enzim lipase dari bakteri diawali dengan penanaman bakteri dalam media fermentasi yang terdiri dari komposisi gum arab 5%, pepton 1%, , minyak zaitun 10% dengan kondisi optimum pertumbuhan bakteri sebagai berikut: waktu inkubasi 24 jam, suhu 35°C, pH 8.
- Proses pemurnian sampel ekstrak kasar enzim lipase diawali dengan fraksinasi bertingkat menggunakan garam ammonium sulfat dengan tingkat kejenuhan (0-20%), (20-40%), (40-60%), (60-80%) dan 80-100%), dialsis dan kromatografi kolom.
- Enzim lipase hasil pemurnian memiliki karakteristik aktivitas optimum pada pH 8, temperatur 45°C, dan waktu inkubasi 10 menit dengan nilai KM = 0,07 mg substrat/ml dan Vmaks = 1,506 μmol minyak /ml enzim.menit.
- Aktivitas esterifikasi enzim lipase mengalami peningkatan seiring dengan bertambahnya kemurnian enzim yaitu dari 2,38 mmol/ml enzim.menit untuk ekstrak kasar, menjadi 3,81 mmol/ml enzim.menit untuk fraksi amonium sulfat, selanjutnya meningkat kembali menjadi 4,29 mmol/ml enzim.menit untuk dialisis dan 5,24 mmol/ml enzim.menit untuk hasil kromatografi kolom.
DAFTAR PUSTAKA
Annisa, Y. 2006. Studi Penentuan Aktivitas Enzim Lipase dari Bakteri Proteus vulgaris Galur Lokal PP-1 dengan Metode Spektrofotometri UV-VIS dan Metode Titrimetri. Skripsi Sarjana Jurusan Kimia FMIPA Universitas Lampung. Bandar Lampung.
Basri, M., Ampon, K., Wan Yunus, W.M.Z., Razak, C.N.A., dan Saleh, A.B 1995. Enzymic Synthesis of Fatty Esters by Hydropobic Lipase Derivates Immobilized on Organic Polymer Beads. JAOCS 72(4):407-411.
Dosanjh, N.S., dan Kaur, J. 2002. Immobilization, Stability and esterification Studies of A Lipase From Bacillus sp. Journal Biotechnology and Applied Biochemistry. Vol. 36. Hlm 7-12. Punjab University. Chandigarh.
Efendi, S. 2001. Karakterisasi Enzim Lipase Intraseluler dengan Aktivitas Esterifikasi dari Kpaang Rhizopus oryzae TR 32. Tesis. Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Bogor.
Lehninger, A.L. 1995. Dasar-dasar Biokimia I. Erlangga. Jakarta.
Nuraida, L. 2000. Eksplorasi, Karakterisasi dan Produksi Lipase dengan aktivitas Esterifikasi Tinggi dari Kapang Indigenus. Laporan Tahunan Pertama Penelitian Hibah Bersaing VIII/I Perguruan Tinggi. FATETA-IPB. Bogor.
Sumarsih, S. 2002. Uji Aktivitas Lipolitik Beberapa Bakteri Hasil Isolasi dari Pelabuhan Tanjung Perak dan Produksi Lipase dari Strain Terpilih. JIPTUNAIR. Surabaya.
Suhartono, M.T. 1989. Enzim dan Bioteknologi. PAU Bioteknologi IPB. Bogor.
Suhendra, L., Trenggono, Hidayat, C. 2004. Aktifitas Hidrolisis dan Esterifikasi Lipase Ekstrak Kecambah Biji Wijen (Sesamun Indicum). Prosiding Seminar Nasional dan Kongres Perhimpunan Ahli Teknologi Pangan Indonesia (PATPI). Jakarta, 17-18 Desember 2004.
Wang, I.C. 1979. Fermentation and Enzymes Technology. John Wiley and Sons. New York.